講師コラム:百田 邦堯 先生
『 フッ素化学の縁の下 』
コラム著者 百田邦堯先生によるフッ素書籍 大好評取り扱い中!
「<環境と資源から見る>フッ素技術 2
~各種規制と除去・回収・再資源化技術~」
第10回 [ フッ素リサイクル ] (2012/7/17)
天然資源の中で、地殻に存在する量から見ればフッ素元素(625ppmで13番目に多い元素:塩素は130ppmで20番目)は、豊富に存在するように思われる。しかしながら、その多くは種々の鉱物などに幅広く分散しており、利用できる量は意外と少ない。
●フッ素資源問題
天然のフッ素資源として活用できる鉱物資源は、螢石(CaF2)やリン鉱石(Ca10(PO4)3F2)に限られる。世界的には米国地質調査所(USGS)のデーターが最も権威があり、数多く引用されている。これによると、螢石の現在の採掘量は、600万トン/年、埋蔵量23,000万トンで、単純に考えると38年で枯渇する事になる。中国の場合はもっと早い。2010年の蛍石の採掘量330 万ton(世界の54.9%)に対して、埋蔵量は2400ton (世界の10.5%)である。
前に述べたように、フッ素化合物のフローの中で特に重要な物質は、酸級-蛍石、フッ化水素、および、HCFC-22である。財務省貿易統計によると2011年のこれらの物質の全輸入量とその中国依存度(カッコ内)は、酸級-蛍石96,251 ton (85.5%)、フッ化水素86,190 ton (100%)、HCFC-22:27,287 ton (98.2%)で、いかに中国一国への依存度が高いかが分かる。
今後、フッ化水素とHCFC-22については、過去10年間に中国以外の新設プラントがほとんどないことから、暫くは中国依存が続く。一方、蛍石は価格の急騰を受け、中国以外の蛍石鉱山の開拓が積極的に行われており、比較的早く中国依存度が低下すると共に、中国が輸入に転じる日も遠くないようである。
●フッ化カルシウム含有廃棄物
フッ素含有廃水中のフッ素は、ほとんどがフッ化カルシウムとして固定化される。このフッ化カルシウムは蛍石と同じ組成(CaF2)である。現在、産業廃棄物として排出されているCaF2含有廃棄物も、処理操作により、純度や形状を向上できればフッ化水素製造原料として使用できる。
●将来展望
フッ化水素に関しては、フッ化水素の製造拠点が中国にシフトする中で、回収蛍石を主原料とした新しい概念のプラントが必要かも知れない。その中でより品位の低い蛍石を有効に利用できるようにすれば、フッ素のリサイクル率も飛躍的に上がる。
また、水熱分解によるフッ化水素発生・回収技術など、以前に検討された技術を再度掘り起こしてしっかり見直すことが必要だと考えている。
もう一つのフッ素資源であるリン鉱石からのフッ素回収率の向上とその回収物から高効率でフッ化水素の製造をすることが、この分野における最大の技術課題と考えられる。すでに1950年頃から色々検討され、いくつかの技術が実用化されているが、まだまだ満足できるレベルではない。
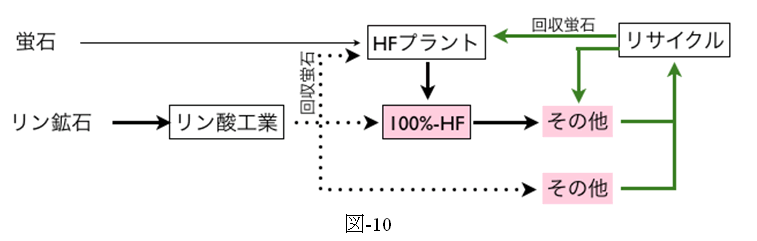
図-10にフッ素資源、フッ化水素およびフッ素リサイクルに関する今後の概念図を示す。
●最後に
フッ素リサイクルに関しては、興味を持たれるユーザーは多いが、現状の処理法に比べて経済的なメリットが出ないとやらない企業がほとんどである。そのためには、より経済的なフッ素リサイクル技術の開発と、フッ素を排出している企業の排出削減に向けた強い社会的な使命感が求められるようである。
個人的には、よりシンプルで受け入れやすいプロセスを如何に確立するかを考えている。
今回、無機フッ素化学を中心に思いつくままコラムを書きました。その中で、フッ素化学のベーシックな部分の奥深さを痛感し、この方面に興味を持たれる方が少しでも増えれば幸いだと思っています。
最後の邪鬼は、 東寺の五重の塔の北東角を支えているものです。

第9回 [ フッ素化学における可逆反応 ] (2012/7/3)
ほとんどの有機化合物は、高温で二酸化炭素と水に熱分解する。 水は2,000℃以上で水素分子と酸素分子になり、さらに2,500℃を超えると原子状の水素と酸素になる。自然界にある物質で、 融点の最高値は炭素(融点3,570℃、沸点4,000℃)で、沸点の最高値はタングステン(融点3,400℃、沸点5,700℃)である。自然界の全ての物質は、6,000℃以上では気体となり、水素分子以外の全ての原子-原子間の結合(化学結合)が切れて原子状気体となる。
概して、高温ではフッ化物よりも酸化物の方が安定である。一方、低温ではフッ化物の方が安定な場合が多い。そのため常温では起こる反応が、温度を上げることにより逆の反応が起こる。
このため、高温では特に水蒸気が存在すると酸化物とフッ化水素を生成する。フッ化水素は、3,000℃の高温でも安定に存在し、水よりも高温域では遙かに安定であることは注目すべき事である。
●フロンの破壊処理
適切なフロンの分解技術として認定された方法は、プラズマ法、燃焼法、セメントキルン法、酸素-水素炎法である。いずれも、高温でフロンを水蒸気(水素を含むフロンは酸素も必要)の存在下で分解する。CFC-12とHCFC-22(図-9)を例に理想的な分解反応式を次に示す。
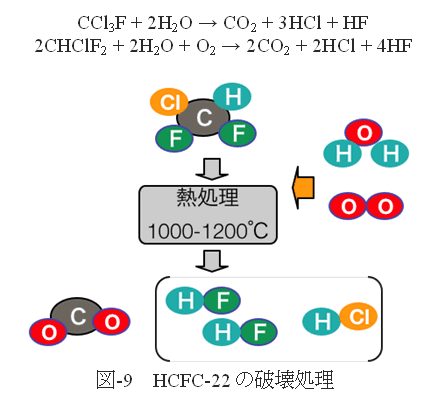
水蒸気がない場合には、不均化反応、二量化反応等が起き、より難分解性の生成物(PFCsなど)や煤などが生成することも確認されている。
現在、オンサイトで、よりコンパクトなフロン分解装置の導入が進んでおり、水プラズマを用いてフロンを分解する方法が主流である。通常、分解ガスは、水と接触することにより、70-100℃まで一気に冷却して、ダイオキシン類の再合成を抑制している。
●無機フッ化物の水熱分解
フロンの破壊と無機フッ化物の水熱分解の類似点が多い。例えば、螢石やフッ化アルミニウムは、1,000℃付近の高温では、次の反応が進行して酸化物と気体のフッ化水素ができる。
CaF2(s) + H2O(g) ---> CaO(s) +2HF(g)
2AlF3(s) + 3H2O(g) ---> Al2O3(s) + 6HF(g)
四フッ化ケイ素(SiF4)と水蒸気でも同様の反応が、遙かに低い温度(約500℃)で起こる。
SiF4(g) + 2H2O(g) ---> SiO2(s) + 4HF(g)
この方法は、古くから高純度の微粒子SiO2の製造に利用されている。ここで生成したフッ化水素は、粗製SiO2と反応させて高純度のSiF4ガスを発生させ、繰り返し利用する。
無機フッ素化合物の水熱分解温度は、フッ化合物の種類により大きく変わる。鉄、銅、クロム、ニッケルのフッ化物は500℃でも水熱分解が起こる。そこで、ステンレス鋼の酸洗(硝フッ酸)に使用した金属フッ化物を多量に含む酸廃液を噴霧して800-900℃で焼成し、金属の酸化物と硝酸・フッ酸を回収するスプレーロースター法が実用化されている。
また、六フッ化ウラン(UF6)などの高次金属フッ化物は、室温で空気中の水分と反応してオキシフルオライドを生成し、より高い温度で酸化物を生成する。多量の劣化六フッ化ウランを貯蔵しているアメリカ、ロシア、フランスでは、劣化六フッ化ウランから無水のフッ化水素を製造するプラントが稼働している。
UF6(g) + 3H2O(g) ---> UO3(s) + 6HF(g)
●蛍石・硫酸--フッ酸・石膏
工業的に無水フッ化水素は、蛍石(CaF2)と硫酸の反応でつくられている。
CaF2(s) + H2SO4(l) ---> CaSO4(s) + 2HF(g) (Δ= 25.6KJ/mol HF)
この反応は、吸熱反応であり、硫酸水素塩の中間体を経て完結するために思った以上に複雑な反応である。
これと、逆の反応が希薄なフッ化水素酸溶液や中性、アルカリ性のフッ素含有水溶液中で起こり、フッ化カルシウムと共に硫酸または硫酸塩を生成する。従って、フッ素含有廃液のフッ素固定化処理に石膏(CaSO4)を利用する方法もある。
今回の邪鬼は、東寺の五重の塔の南東角を支えているものです。この方面は木々が生い茂っており、正面から見ることが出来ない。

第8回 [ 有機電解フッ素化 ] (2012/6/19)
電解により有機化合物にフッ素を導入する4つの方法がある。Simons 法、Phillips 法、部分フッ素化法、ペルフルオロアルキル化法で、それぞれ異なった反応機構で進行する点で非常に興味がある。
Simons 法とPhillips法は、いずれも陽極で酸化される基質は、酸化電位が高いフッ素アニオン(F - )であると考えられている。これが電極反応で酸化されて非常に反応性が高いフッ素ラジカル(F ・ )を生成する。このため、厳しい条件下(高い電圧)で行われる。一方、部分フッ素化法とペルフルオロアルキル化法は、フッ素アニオンよりも遙かに酸化電位が低い有機基質が電極反応に関与するため、比較的穏和の条件下で行われる。概して電極反応は単純であるが、その後で起こる化学反応の方が、複雑で難しい。
●パーフルオロ化(Simons法)
この方法は、1930年代に3M社の援助を受けてペンシルバニア州立大学の J. H. Simonsにより発明された。しかしながら、六フッ化ウランの製造とのその関連事項として機密扱いとなり、第二次世界大戦の後まで、この研究結果は公表されなかった。(J. H. Simons et al., J. Electrochemical Soc. 95 47-66 (1949).)
ニッケル陽極を用い、電解液に有機物などを溶解させた無水フッ化水素を用い、5-6Vのセル電圧下で電解を行い、陽極でペルフルオロ化合物を生成し、陰極から水素を発生する。
Simons法は、官能基を有するアミン、エーテル、カルボン酸、スルホン酸などのペルフルオロ化合物を合成する重要な手段である。1950年代には3M社によりフッ素系の界面活性剤や撥水・撥油剤の原料の合成方法として工業的に確立された。現在PFOS/PFOA問題で対象となっているフッ素系界面活性剤は、当初この方法で合成された。また、トリフルオロスルホン酸(CF3SO3H)、不活性液体などの合成方法として今も健在である。
●Phillips 法( CAVE:Carbon Anode Vapor Phase Electrochemical Fluorination)
Phillips法は、フッ素ガスを製造する方法を工夫したものである。電解により多孔質炭素陽極内で発生させたフッ素ラジカルまたはフッ素と、この多孔質炭素電極内に強制的に導入されたガス状有機化合物を反応させる。反応条件により部分的にフッ素化された物から完全にフッ素化された物まで得られる。この方法は、Phillips Petroleum 社で開発され、主に揮発性の炭化水素および塩素化された炭化水素のフッ素化に使用され、水素はフッ素に置換されるが、塩素は置換されにくい特徴がある。その後、3M社で実プラントが稼働していると言われている。
●部分フッ素化
有機基質を電解酸化させることにより生成するカチオン種(ラジカルカチオン類とカチオン類)に、F - が付加すると部分的にフッ素が導入された生成物が得られる。F - の酸化が起こらない穏和な条件下で電解合成が行われる。電解液としては、非プロトン性の溶媒に有機基質と支持電解質塩兼フッ素イオン源となるフッ化物を溶かした系、または常温で液状を呈するアミンや4級アンモニウムフルオライドのHF 塩またはHF溶液が用いられている。陽極材として白金または炭素が用いられている。
●ペルフルオロアルキル(R f )化
ペルフルオロアルキル化は、ペルフルオロアルキルカルボン酸類(R f COOH)の電解酸化によりペルフルオロアルキルラジカル(R f ・ )を発生させる方法と、 ペルフルオロアルキルハライド類(R f X)の電解還元によりを R f ・ 発生させる方法に大別できる。発生したこれらのR f ・ が電解液中に存在する有機物にトラップされてペルフルオロアルキル化された有機化合物を生成する。
a) R f COOHの電解酸化
R f COOH-R f COONa-CH3CN-H2O電解液系で反応基質を溶解させて電解酸化を行うとR f COO - が酸化されてラジカル(R f COO ・ )を生成する。そのラジカルは脱炭酸反応を起こしR f ・ を発生し、バルク中で基質となる有機化合物と反応してペルフルオロアルキル化合物を生成する。
比較的安価なペルフルオロカルボン酸を原料に使用するため、その応用範囲が広がることが望まれるが、原理的に非常に酸化電位の高い限られた基質しかR f 基の導入ができない。一般の化合物は、先に酸化されて、部分フッ素化と類似した反応機構により、R f COO基が導入された生成物が得られる。トリフルオロ酢酸を用いたトリフルオロメチル化が良く研究されている。
b)R f Xの電解還元
R f X を支持電解質(例えば、Et4NBF4) を含む非プロトン性溶媒(DMSO 、DMFなど)中で、直接または間接的に電解還元を行うと、R f ・ が発生する。そのラジカルは求核性のある基質(例えば、イミダゾール、ウラシル、プリン)と反応して、ペルフルオロアルキル基を有する有機化合物を生成する。
今回の挿絵は、東寺の五重の塔-南西角を支えている邪鬼である。この邪鬼が一番軽々と軒を支えている感じがする。

第7回 [ フッ素と電気化学 ] (2012/6/5)
フランスは電気化学の分野における研究が盛んな国で、特に、1886年は記念すべき年である。この年、Paul Heroultは、現在もアルミニウム精錬技術の主流である、いわゆるホール・エール法を開発した。同年、Henri Moissanは、電気分解によりフッ素ガスの単離に成功した。このアルミニウムの工業電解法考案とフッ素単離の偉業百年目を記念して1986年フランスで発行された記念切手を図7に示す。
なぜか、フッ素を単離する反応が逆になっているのが、非常に気になります・・・。切手の値段で評価すれば、ノーベル賞をもらったMoissanよりも工業電解技術を開発しフランスに巨万の富をもたらしたHeroultの業績の方が偉大なのでしょうか?

図7
●アルミニウム電解
鉄や銅が古代から使われてきたのに対し、アルミニウムの歴史は新しい。アルミニウムは、クラーク数で、酸素、ケイ素に次いで3番目に多い元素である。これが最近まで利用できなかったのは、安定な酸化物として存在するために精錬が難しかったことによる。
金属アルミニウムが初めて単離されたのは、1825年で、デンマーク物理学者エルステッド(Hans Christian Orsted)が、塩化アルミニウムをカリウムアマルガムで還元する方法で得た。
1886年、アメリカの大学院生ホール(C. M. Hall)は溶融した氷晶石(Na3AlF6)中に酸化アルミニウム( Al2O3)を溶かし、これを電気分解することにより金属アルミニウムの製造に成功し、1889年米国で特許を取得した。 同時、フランスのエール(Paul. L. Heroult)もこの方法を開発し、1889年5月にフランス、ベルギー、英国およびスイスで特許を取得した。ホールとエールが発明した電解精錬法は、現在の精錬法と基本原理は同じである。二人は、同じ年に生まれ、同じ年に発明し、1888年に生産工場を興し、1914年に51才で没した。
この電解反応は:(陽極反応)Al2O3 + 3C --> 2Al3 + + 3CO↑ + 6e - (陰極反応)2Al3 + + 6e - --> 2Al である。
炭素極は酸化されて一酸化炭素(CO)を発生する消耗電極である。1000℃付近の高温下で電解されるために、電解浴中のフッ素分は、CF4 、NaAlF4 、HFなどで揮発して損失する。アルミニウム地金1トンを製造するために30-60kgのフッ化物を消費する。損失分は、AlF3 、NaF 、Na3AlF6で補充され、この量は生産されている全フッ素化合物の約3割に相当する。
このホール・エール法と、2年後に開発されたバイヤー法(アルミナの製造法)により、アルミニウム産業は飛躍的に発展した。
●フッ素電解
フッ素(F2)は、フッ素化学の世界では、フッ化水素に次いで大事なもので、フッ素なしでは出来ないフッ化物が、六フッ化ウラニウム(UF6)、六フッ化タングステン(WF6)などの高次金属フッ化物を始め、高度にフッ素化された非金属フッ化物および有機フッ素化合物が数多く存在する。
1986年、モアッサン(Henri Moissan)により、初めて電解によりフッ素が単離された。彼は、この業績により、1906年に「フッ素の研究と分離、およびモアッサン電気炉の採用」でノーベル化学賞を受賞した。
現在、フッ素電解は溶融塩電解の分野に属し、電解浴としてほぼKF・2HFの組成(融点:約72℃)が使用され、炭素陽極と鉄などの陰極を用いて、80-110℃で運転されている。図8にKF-HF系のHFモル分率による融点の関係を示す。KF・2HF付近で融点は安定し、この点でのHFの平衡分圧が低い。
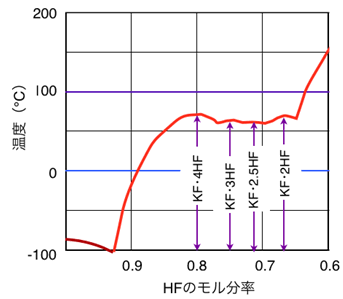
図8
フッ素電解槽は、理論電解電圧よりも遙かに高い電圧で運転されるため、電解時の発熱が大きく除熱のために大型化が難しいと言われている。ロシアには1槽で20,000Aのものがあるが、世界の主流は4,000-6,000Aである。
●含フッ素電解質
リチウム(イオン)電池の様な高い電圧で作動する電池は、プロピレンカーバイト、ジエチルカーボネートのような電位窓の広い有機溶媒が使用される。その支持電解質塩として前述した、LiPF6 、LiBF4などの無機含フッ素リチウム塩に加えて、CF3SO3Li 、(CF3SO2)2NLiなどの有機含フッ素リチウム塩が用いられている。また、高性能キャパシターの電解質塩として(C2H5)4NPF6 、 (C2H5)4NBF4などが使用されている。
これらの含フッ素アニオンは、電解液中でイオンとして電気を流す働きをするが、電極反応に関与することはなく、安定に保持される。
今回から10回にかけての挿絵は、東寺の五重の塔の四匹の邪鬼です。次の挿絵は、北西角を支えている邪鬼で、五重の塔を拝観すると最初に目にするものです。

第6回 [ 無機フルオロ錯化合物 ] (2012/5/22)
フッ素は、最も電気陰性度が強い元素として知られている。ポーリング電気陰性度は、高い順に、フッ素が3.98で、酸素3.44、塩素3.16と続く。この観点から見れば、フッ素は塩素よりも、酸素に近い挙動を示す。酸素化合物には、ある原子にオキソ基(=O)とヒドロキシ基(-OH)が結合した、オキソ酸が数多く存在する。無機化合物のオキソ酸の例としては、硫酸、硝酸、リン酸などがある。
フッ素化合物にも同様のフルオロ錯化合物が、安定に多数存在し、フッ素と酸素の組み合わせからなるオキシフルオライドも存在する。
●無機フルオロ錯体
フッ素は、強い電気陰性度により、ほとんど全ての元素と低い原子価から最も高い原子価まで多種類のフッ化物をつくる。これらのフッ化物が、アルカリ金属フッ化物、アルカリ土類金属フッ化物、フッ化アンモニウムなどと結びついて、さらに多くのフルオロ錯体を形成する。
無機フルオロ錯体は、一般的に[Am + ] x [MFy] n - で表される。Aは錯体中の陽イオンとなるアルカリ金属、アルカリ土類金属、アンモニウムなどで、mはその価数である。Mはフルオロ錯イオンの中心分子であり、これにy個のフッ素イオンが配位している。
天然には、氷晶石(Na3AlF6)が知られているが、天然に産出するその類似物質として、chiolite (Na5Al3F14)、 cryolithionate (Na3Li3(AlF6)2)、 thomsenolite (NaCaAlF6・H2O)、 jarlite (Na2MgAlF7)、 pachnolite (NaCaAlF6・H2O)などがある。本当に複雑な世界である。
●無機フルオロ錯体の酸
無機フッ素化合物の中で、三族~六族の元素は、沢山のフッ素を結合したフルオロ錯アニオンを形成し、それらの酸が安定した状態で存在する。例えば、HBF4、H3AlF6、H2SiF6、HPF6、HSbF6、HAsF6、H2TiF6、H2ZrF6などである。
面白いことにこれらの酸、例えば、H2SiF6、HBF4、H2TiF6、H2ZrF6などは、水の存在下で安定である。これらは、40~50wt%の水溶液として市販されているが、濃縮すると分解するために濃厚な酸にすることができない。無水の状態で、前述のスーパーアシッド(HF-SbF5、HF-BF3など)として存在するが、これらは完全に非水系である。
●リチウム(イオン)電池用支持電解質
リチウム(イオン)電池用支持電解質に求められる要件は、ⅰ)非水溶媒に良く溶ける ⅱ)高い電気伝導度を与える ⅲ)化学的・電気化学的に安定 ⅳ)より安全で、毒性が少ない ⅴ)安価であるなどである。 ハードなカチオンであるLi + と、イオン半径の大きな一価のアニオンとの組み合わせは、リチウム(イオン)電池用の非水溶媒系に良く溶解し、高い電気伝導度を与える。
六フッ化リン酸リチウム(LiPF6)と四フッ化ホウ酸リチウム(LiBF4)は、リチウム電池用の支持電解質として工業的に重要なものである。フッ素系以外のソフトなアニオンとの組み合わせで、過塩素酸リチウムがあるが、これを用いた電池の爆発事故などにより、利用が限られている。また、六フッ化ヒ素酸リチウム(LiAsF6)は、支持電解質としての特性が優れており軍事用のリチウム電池に古くから使用されている。しかしながら、民生用の電池としては、高いヒ素の毒性により使用できない。
LiPF6およびLiBF4は、高純度のフッ化リチウム(LiF)と五フッ化リン(PF5)または三フッ化ホウ素(BF3)の反応で合成され、次の平衡状態が存在する。これらは、中低温域では安定であるが、高温になると不安定になる。
LiBF4 (固) ⇔ LiF (固) + BF3 (気)
LiPF6 (固) ⇔ LiF (固) + PF5 (気)
●安定なのか/不安定なのか?
フッ化水素酸は、無水から40%含有物まで種々の濃度のものが市販されている。一方、ケイフッ化水素酸(H2SiF6)は40%水溶液のみが市販されている。より高濃度の H2SiF6 は、四フッ化ケイ素(SiF4)を揮発するので取り扱いにくくなる。SiF4の毒性(0.05ppm*)は、HF(1ppm*)よりもはるかに高い。
*前述の60分暴露時のPAC-1( 不快感やわずかな刺激が生じない空気中の最大濃度)
20%以下の低濃度の H2SiF6 は、SiF4やHFをほとんど留出することなく濃縮できる。この技術は、リン酸工業で発生するSiF4を水に吸収させ、20%以下の H2SiF6 として回収する技術に利用されている。
一方、高濃度の H2SiF6 を蒸留すると水と共にSiF4が留出し、大部分のHFは釜に残る。さらに、硫酸などの添加するとSiF4は揮発し易くなる。まず、SiF4を留出させたのち、さらに温度を上げてHFを蒸発・回収する技術もある。その概要の一例を図6に示す。
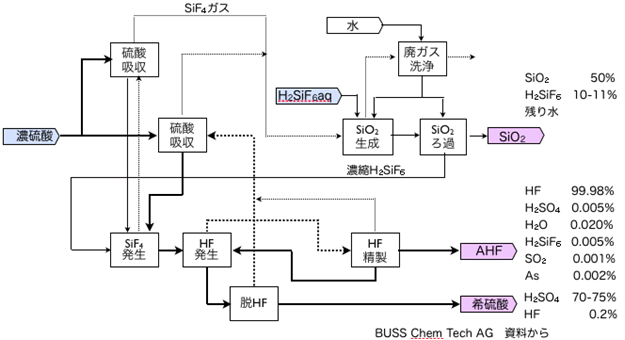
図6

第5回 [ HFが配位した塩類 ] (2012/5/8)
フッ化水素(HF)を含む安定な化合物として、酸性フッ化アンモニウム(NH4HF2)、酸性フッ化ナトリウム(NaHF2)、酸性フッ化カリウム(KHF2)などの酸性フッ化物が存在する。このような化合物は、フッ化物特有の物であり、他のハロゲン化水素類では見られない。フッ化水素は、強い極性を持つ共有結合の化合物である。大きな双極子モーメントと高い誘電率を有し、水素結合を生じやすい。
液体の無水フッ化水素は、4量体((HF)4)での存在が知られている。また、フッ化水素酸の濃厚な溶液中に、F - に1個のHFが配位したHF2 - だけでなく、2個、3個とHFが配位した、(HF)2F - 、(HF)3F - などが存在する。
●MF(HF)の安定性
この種の安定な化合物として、NaHF2、KHF2、CsHF2、RbHF2、NH4HF2がある。いずれも水溶液系から結晶として回収できる。LiHF2は、低温においてのみ安定で、常温・常圧下で徐々にHFを放出してフッ化リチウムになる。これらの固体には、HFの平衡分圧が存在する。カチオンのイオン半径が大きいほどその平衡分圧は低く、より安定になる。その例として、酸性フッ化ナトリウムの平衡式と温度によるHFの平衡分圧の式を次に示す。
NaHF2(固) ⇔ NaF(固) + HF(気) In PHF(atm) = In Kdiss = △Gdiss/RT
log PHF(atm) = 6.677 - 3940/T (310-3710 °K)
log PHF(atm) = 6.594 - 3521/T (430-542 °K)
この反応は、気体中のHFをトラップするのに利用される。HFなどの吸着を目的としたペレット状のフッ化ナトリウムも市販されている。例えば、フッ素ガス中のHFを除去する方法では、HFの吸着し過ぎによる熔融や固化を防ぐために、100℃付近でHFを吸着させ、ここで生成した酸性フッ化ナトリウムを300℃に加温してHFを放出させてフッ化ナトリウムを再生し、繰り返し使用する。
KHF2は、Fremy塩とも呼ばれ、通常の乾燥で水分を容易に除去することができる。この乾燥した塩を400-500℃に加熱して熔融状態でHFを放出させ、冷却・回収すると無水のHFが得られる。この方法は、1856年にEdmond Fremyにより、最初の無水HFの単離法として見出され、その後、フッ素化学の発展に重要な役割を果たした。現在、KHF2は、フッ素電解用の電解液(KF- 2HF)の原料に使用されている。
●イオン液体としての(Large) + F(HF)n -
一価のカチオンで、さらにイオン半径の大きなもの、例えばイミダゾリウム類、ピリミジウム類、四級アンモニウム類のF(HF)n - などは広い範囲のn値で、常温で液体を呈するフッ化水素系のイオン液体になる。これらのイオン液体の利用を図5に示す。
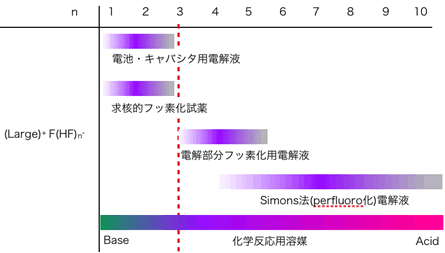
図5 MF(HF)nの利用
n<3では、F(HF)n - は、 フリーのHFがほとんど存在しなくなり、 塩基としての性質が強くなる。そのため、電池やキャパシター用の電解質、求核性フッ素化試薬として利用できる。逆に、n>4では、フリーのHFの存在により、酸としての性質が強くなる。この系で電解を行うと陰極での水素発生がスムーズに起こり、陽極での電解フッ素化の電流効率が良くなる。
●KF-HF系、CsF-HF系、NH4 - HF系溶融塩電解
フッ素ガスを製造するための電解液は、90℃付近で安定した溶融塩として存在するKF-2HF組成のものが使用される。いわゆる、中温法と呼ばれるフッ素電解合成法である。 CsF-HF系は、KF-HF系より低い温度で溶融塩として安定して存在するが、セシウムが高価なために実用化されていない。フッ素は極めて酸化性の強い物質で、フッ化水素の理論電解電位は、2.85Vである。水の理論電解電位1.23Vと比べてずっと高い。このため、フッ素の製造は、電解法による製造に頼るしかない。
現在、半導体産業でクリニングガスとして多量に使用されている、三フッ化窒素(NF3)の合成方法の1つとして、NH4 - HF系溶融塩系での電解法がある。

第4回 [ HFおよびHF混酸 ] (2012/4/17)
●弱酸?
フッ化水素酸が弱い酸であることは意外に思いませんか?我々フッ素化学の専門家でもその実感に少し欠けるのが現実です。その強烈な個性ある反応性と有害性にあるのではないでしょうか?
確かに水溶液であるフッ化水素酸の酸解離常数pKaは3.2で塩酸の-2.2、臭素酸の-4.7、硫酸の-3.0と比べても遙かに弱い酸である。
図3にpHによるHFの解離状況を示したもので、pH 3.2でHFの半分は解離せずにHFで存在し、pH 1以下ではフリーのHFが約96%存在します。このことはあくまでも水溶液系の話です。
高濃度溶液、混合溶媒系、超酸など、水素イオン指数(pH)が適用できない系では、通常ハメットの酸度関数( H0 )が使用される。
ハメットの酸度関数値は強い酸性であるほど負に大きな数値となる。例として、25℃での 5%硫酸水溶液の H0 は -0.02、100%-硫酸は -12である。無水のフッ化水素は-11の強い酸であり、微量の水分の存在により酸度は著しく低下する。
100%-硫酸より強い酸をスーパーアシッド(超強酸)という。
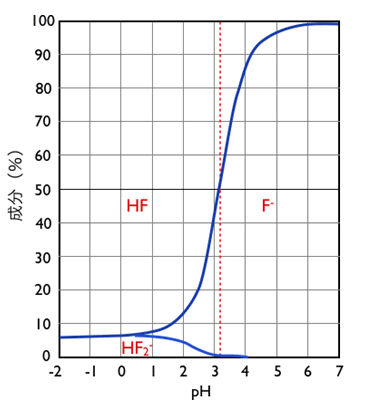
図3
●スーパーアシッド(超強酸)
化学の世界で最も強い酸は、フッ化水素(HF)と五フッ化アンチモン(SbF5)との等モルの混合物で、フルオロアンチモン(V)酸(HF-SbF5)と呼ばれる。 この系では、まずフッ化水素がプロトン (H+) とフッ化物イオン(F-)に分かれ、そのフッ化物イオンが五フッ化アンチモンと強く結合して八面体型アニオン (SbF6-) を作る。このアニオンは塩基性、求核性が非常に弱いため、遊離したプロトンは非常に反応性の高いフリーのプロトンに近づく。その酸性は、極めて高く100% 硫酸と比較して約1016倍の強さである。
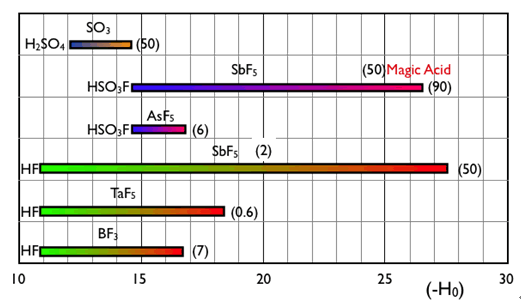
図4 代表的な超強酸の範囲 ( )内はルイス酸のmol%を示す。
また、フッ硫酸(HSO3F)と五フッ化アンチモンの混酸(HSO3F-SbF5)は、Magic Acid と呼ばれ、1960年頃この分野の第一人者のGeorge A. Olahにより開発された。その名称は、クリスマスパーティーで使ったロウソクの蝋を魔法のように溶かしたことに由来する。彼は、それまで不安定な化学種とされてきたさまざまなカルボカチオン種を 超強酸を用いて直接観測する手法を確立させ、それらの性質を明らかにした。その業績などから、「カルボカチオン化学への貢献」で1994年にノーベル化学賞を受賞した。
代表的な超強酸のハメットの酸度関数をプラスマイナスを逆にした(-H0 )の範囲を図4に示す。ここに示すように -H0 は、加えるルイス酸の比率により大きく変化する。
●HF混酸
酸で表面を溶かす、いわゆるケミカルエッチングの世界ではフッ化水素酸は非常にユニークであり、大事な物である。フッ化水素酸は単独でガラスの主成分であるシリカ(SiO2)を溶解する。特に硝酸とフッ化水素酸の混酸は、硝フッ酸と呼ばれ金属シリコンのケミカルエッチング、ステンレスの酸洗、原子力産業における使用済み燃料の処理などに重要な役割を担っている。
金属シリコンのケミカルエッチングでは、硝酸とフッ化水素酸の役割は明確で、シリコンは硝酸で酸化されて表面にシリカ(SiO2)を生成し、このシリカをフッ化水素酸で溶解することを繰り返してエッチングが起こる。
ステンレス鋼のスケールは一般の鋼スケールに比べて緻密である。種々の酸のうち、特に硝フッ酸は、酸洗能力が最も強く、短時間で美麗な表面が得られることから、ステンレス鋼(特に、オーステナイト系ステンレス鋼)の酸洗で広く使用されている。通常、硝酸(3~10wt%)フッ酸(3~5wt%)の組成の硝フッ酸が使用され、脱スケールとともに不動態化の処理も兼ねて実施されている。
使用済み燃料中の核燃料物質の抽出・純化を行う”Purex法”の前処理として、これら核燃料物質を溶解する必要がある。酸化ウラニウム(UO2)は硝酸単独で溶解できるが、酸化プルトニウム(PuO2)や酸化トリウム(ThO2)は溶け難い。このため、経済的に使用済み燃料を再処理するためにフッ化水素酸を加えた硝フッ酸が使用される。 酸化プルトニウム を溶解するためには10M-HNO3 + 0.1M-HFが、酸化トリウムを溶解するのに13M-HNO3 + 0.5M-HFが良いと言われている。
その他のHF混酸に、ガラスエッチングに使用されているHF-HCl混酸、HF-H2SO4混酸、ケイ素鋼の酸洗に使用されている HF-H2SO4混酸、半導体産業におけるエッチング速度を調整するためのバッファードフッ酸(NH3-HF混酸)などがある。

第3回 [ フッ素と健康 ] (2012/4/3)
フッ素やフッ化物と言えば、極めて危険な物質を連想し、フッ素樹脂やフッ素塗料と言えば高価で優れた性能を持つ貴重な材料であると思っていませんか?
●フッ素は必須微量元素
人体を構成している主な元素は、炭素(C)、水素(H)、酸素(O)、窒素(N)の4種類[( )内は元素記号]で、これらで約96wt%を占めている。人体の60~70%は水である。次に多い順にカルシウム(Ca)、リン(P)、カリウム(K)、硫黄(S)、ナトリウム(Na)、塩素(Cl)、マグネシウム(Mg)である。さらに、量的には少なくても生命にとって欠くことができない多くの元素があり、それらを「必須微量元素」と呼ぶ。表1に必須微量元素で体内量の多い4種の成人体内量、必要量、その特性などを示す。フッ素はその中で2番目である。
表1
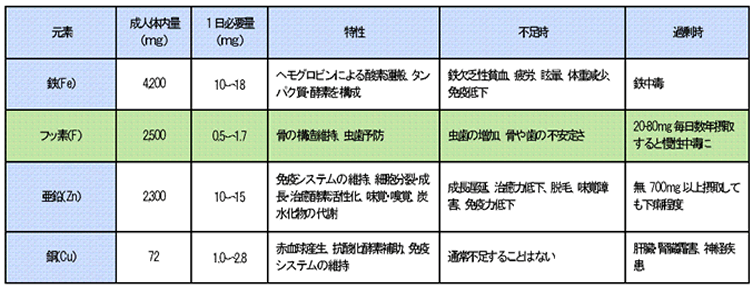
この他に、バナジウム(V: 成人体内量18mg)、砒素(As: 18mg)、セレン(Se: 13mg)、ヨウ素(I: 11mg)、ニッケル(Ni: 10mg)、モリブデン(Mo: 9mg)、クロム(Cr: 1.5mg)、コバルト(Co: 1.5mg)、ケイ素(Si)がある。
必須元素あるいは必須微量元素は、摂取量が過剰になれば、その元素の毒性による機能的障害が現れ、さらに多いと死に至る。逆に、不足すれば正常な代謝機能を果たすことが困難となり、病的疾患いわゆる欠乏症が現れ、極端な場合には死に至ることもある。すべての生物は、微量元素の必要量の範囲をうまく保って、生命を維持させている。
フッ素は人体中で13番目に多い元素であり、人体の血液中に 0.08ppm、骨中に1,000~3,000ppm、エナメル質表層500~1,000ppm、中間層に50ppmが含まれている。フッ化物の摂取は、主として飲食物からである。飲み物はほとんどが胃壁から吸収され、食物は約半分が胃壁から吸収され残りは糞便として排出される。吸収されたフッ化物は血中を介してほとんどが尿として排出され、残りのフッ化物は骨や歯に一時的に蓄積され必要なときに血中に供給される。適量のフッ化物は骨や歯を健康に維持することに関与していると考えられている。
●歯磨き粉の中のフッ素
フッ化物入り歯磨き粉には、フッ化ナトリウム(NaF)、モノフルオロリン酸ナトリウム(Na2PO3F)、フッ化スス(SnF2)が使用され、その有効性が確立されている。虫歯予防のために入れられており、1990年のFDI(国際歯科連名)の調査で、口腔保健の先進国において90%を超える普及率である。日本でも、近年になってフッ化物を含む歯磨剤のシェアが上昇し、2008年現在で市販されている歯磨剤のうち、89%でフッ化物を含有している。薬事法により配合されるフッ化物イオン濃度は1,000ppm以下に規制され、市販のフッ化物入り歯磨剤におけるフッ化物濃度は、900ppmから950ppmである。
フッ化物の虫歯予防に対する効果は次のとおり。
①虫歯菌のはたらきを抑制
虫歯菌の酵素(エノラ-ゼ、フォスフォグリセロムタ-ゼ)の働きを抑制して、歯を溶かす酸を作らないようにする。 また、虫歯菌の栄養となる糖の取り込みを邪魔して、菌が歯にくっつき易くする”ネバネバ”物質を作ることを抑える。
②酸に負けないために歯質強化
1)耐酸性向上 歯の表面を構成するハイドロキシアパタイトから歯を溶かす酸に強いフルオロアパタイトを作りエナメル質を硬く丈夫にする。
2)虫歯抵抗性 歯のエナメル質結晶の弱い箇所を修復し、より強固な結晶を作る。
3)再石灰化 フッ化物は唾液中のカルシウムイオンやリン酸イオンと共に虫歯菌の出す酸で溶けかかった歯(脱灰)の表面に沈着し、歯の表面を修復する。
●類似性と毒性
一般に化学物質の毒性について、類似物質からの推測の概念が当てはまらない。そのため、事前に化学物質ごとの毒性や事故時の対応などを確認する必要がある。まずは各化学物質のMSDS(Material Safety Data Sheet)を取り寄せ、理解する。
毒性が強い有機フッ素化合物で、自然界に存在するモノフルオロ酢酸(CH2FCOOH)とフッ素樹脂の熱分解時に僅かに発生するイソオクタフルオロブタジエン((CF3)2CF=CF2)の2種について、類似物質との毒性を比較する。
比較は、米国で使用されている60分暴露時のPAC-1*( 不快感やわずかな刺激が生じない空気中の最大濃度)で行った。
CH3COOH(5ppm)>CHCl2COOH(1.5ppm)>CCl3COOH(1ppm)>
CH2ClCOOH(0.6ppm)>CF3COOH(0.17ppm)>CH2FCOOH(0.043ppm)
CF2=CF2(220ppm)>CF3CF=CF2(40ppm)>CF2=CFCl(16ppm)>>(CF3)2CF=CF2(NR:検出されないこと)
続いて、安全で安定な六フッ化硫黄(SF6)について類似物質と比較する。
SF6(1000ppm)>>SF4(0.19ppm)>S2F10(0.01ppm)
*http://www.atlintl.com/DOE/teels/teel/Table3.pdf(Protective Action Criteria (PAC) Rev 27 based on
applicable 60-minute AEGLs, ERPGs, or TEELs. The chemicals are listed by CASRN. February 2012 3387種)
今回のコラムから6回目まで、法隆寺五重の塔の最下層の軒を支えている四匹の邪鬼を順に挿絵に選びました。今回の邪鬼は頭で軽々と軒を持ち上げています。
 
第2回 [ 自然界のフッ素 ] (2012/3/21)
海水のフッ化物濃度はこの6億年もの間、ずっと1.3 ppmと変化なく推移してきたことがわかっている。この6億年というのが現在のすべての生物が重要な進化をとげた時期にあたり、生物は1.3 ppmのフッ化物濃度雰囲気の中で進化してきた。現在のすべての海に棲む生物にとって
このフッ化物濃度が最も好ましい環境であると考えられる。
虫歯予防で飲料水に含まれる最適濃度がこの付近であることは偶然なのでしょうか?
●マグマとフッ素
元来マグマの中に含まれているフッ素原子の量は、決して少なくはない。その一部は、火山性ガスとして放出され、ある物は地殻変動により蛍石、リン鉱石などの鉱物として固定化される。
火山ガスとは、地中のマグマ中に溶存する揮発性成分がマグマの上昇などで圧力解放されることにより気化し、地表に噴出したもので、多くの成分が含まれている(図2)。
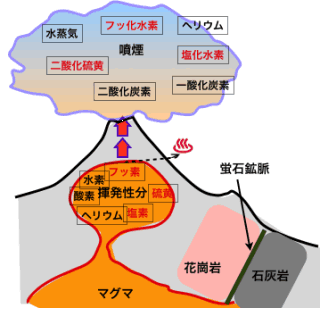
図2
地球上の火山地帯から放出される火山性の有毒ガスは、亜硫酸(SO2)4,750トン/日、塩化水素(HCl)750トン/日、フッ化水素(HF)190トン/日に達すると言われている。年間6万9千トンのフッ化水素が放出されていることになり、現在日本で生産されているフッ化水素の量よりも多く、日本で使用されているフッ化水素の約半分に相当する。
●蛍石、リン鉱石そして氷晶石
フッ素を含有する鉱石は沢山あるが、工業的価値があるのは 蛍石、リン鉱石そして氷晶石である。
蛍石は、花崗岩マグマが固結してゆくとき、フッ素の一部は花崗岩中の雲母に取り込まれるが、大部分のフッ素は最末期に絞り出される流体中に、水、硼素、塩素などと共に濃縮される。その流体は、大きな結晶からなる火成岩の一種であるペグマタイトや派生する熱水鉱脈中に、また石灰岩と遭遇したところで、フッ素の固定化が起こり、そこに厚さ数mから数十mの蛍石の帯状鉱脈を生成する。蛍石資源の推定埋蔵量は、47,000万トン、その内経済的に採掘が可能な可堀埋蔵量は23,000万トンであり、現在年間600万トン弱が掘られている。単純計算で38-78年で枯渇することになる。資源問題がクローズアップされるたびに蛍石の価格も高騰しており、2000年に比べて日本への酸級蛍石の輸入価格は4-5倍に跳ね上がった。
リン鉱石の主成分は、フッ素アパタイト(Ca10(PO4)6F2)であり3%強のフッ素を含有する。その資源の成因に他の鉱物資源と比べて多彩で、地殻変動で生じた無機質のリン鉱石鉱床(火成鉱床)に加えて、古代の動植物や微生物が起源のリン鉱石鉱床(化石質鉱床)、海鳥糞によるグアノ鉱床がある。この内、大きなものは化石質鉱床でモロッコ・西サハリに埋蔵量500億トンと途方もなく大きな鉱脈がある。
氷晶石は、1799年に西グリーンランドで結晶としてまとまって発見された。この結晶は、屈折率が水とほぼ同程度であるためにその透明な結晶を水の中に入れるとほとんど見えなくなることから、溶けない氷と言うことで氷晶石と呼ばれる。18世紀後半にアルミニウムの電解精錬(ホール・エール法)で氷晶石が融剤として使用されるようになり、グリーンランドは氷晶石の輸出で莫大な富を得たが1987年に埋蔵量が底を突いたため閉山した。現在市販されている氷晶石は、すべて合成品である。
●自然界の毒-モノフルオロ酢酸
前回、自然界に存在する有機フッ素化合物はほとんどないことを紹介した。南アフリカ共和国のトランスヴァール地方に産するDichapetalum cymosumと呼ばれる植物は、モノフルオロ酢酸カリウムを含んでいる。モノフルオロ酢酸カリウムを含むこの植物は、心臓毒としては世界で最も毒性の強い植物である。羊1匹を殺すのに生葉30gほどで十分である。モノフルオロ酢酸は生体内でフルオロアセチル補酵素Aに代謝された後、クエン酸回路に入りモノフルオロクエン酸となり、アコニターゼの反応を阻害するため高い毒性を示す。
有機フッ素化合物は自然界に、ほとんど存在しない。そのため、自然界に有機フッ素化合物を分解して無機化する酵素はほとんど存在しない(最近、この分野での研究がされている)。フロンによるオゾン層の破壊問題やフッ素系界面活性剤によるPFOS/PFO問題もフッ素化合物が安定で分解しにくいことが起因しており、代替え品としてより自然界で分解されやすい有機フッ素化合物の開発に力が注がれていることは皮肉な話である。
今回の挿絵は、東大寺の二月堂の「邪鬼足外香炉」と呼ばれる大香炉を支えている三匹の邪鬼です。

第1回 [ フッ素化学の縁の下 ] (2012/3/6)
●はじめに
私は長年フッ素化学の分野において基礎研究からプラントまでと幅広く従事してきた。
その中で、ここ十数年は、この分野の関係者がほとんど見向きもしないコモデテイー化された部分での技術革新を含めた底上げの必要性を強く感じ、フッ素リサイクルやフッ化水素の製造などの分野における基礎技術の体系化や埋もれた技術の発掘などに残りの人生をかけてみようと考えている。今回、フッ素化学の分野でも日頃目立たない無機フッ素化学を中心としたベーシックな部分で話題を提供していきたいと強く感じコラムへの掲載を引き受け、「フッ素化学の縁の下」と題をつけた。
挿絵にしようと縁の下の力持ちと言うべくキャラクターを探していたところ、法隆寺や東寺の五重塔の最下段の軒下を一生懸命支えている「邪鬼」の存在を知り、いつも四天王に踏んづけられて泣きそうな邪鬼とは全く違う力強さと使命感を感じ、大いに親しみを持った。邪鬼=ジャッキーと書いてた人もあり大いに納得した次第である。今回は、東大寺大仏殿の「邪鬼足外香炉」と呼ばれる大香炉を支えている三匹の邪鬼を挿絵にした。
●フッ素化学を支える無機フッ素化学
自然界に存在する含フッ素化合物は、ほとんど無機化合物である。有機のフッ化物は、モノフルオロ酢酸、モノフルオロカルボン酸類などわずか十数種の存在が知られているだけであり、いずれも分子内にわずか一個のフッ素原子を含んでいるだけの猛毒な物質である。
一方、身の回りに存在するほとんど含フッ素化合物は有機フッ素化合物であり、無機フッ素化合物は僅かフッ素入り歯磨き粉に0.1%弱含有しているフッ化ナトリウム、フッ化スズ、あるいはモノフルオロリン酸塩ぐらいである。分子内に沢山のフッ素原子を持つ有機フッ素化合物は、極めて安定で耐光性・耐久性が向上するだけでなく、特殊な機能性を発現する。それらの機能性により我々の日常生活がより利便的になっている。例えば、焦げ付かないフライパンにはフッ素樹脂コーティング、防水・防汚のためのフッ素系撥水・撥油剤、フッ素塗料、フッ素系ガラスコーティングなどがある。
すべての有機フッ素化合物は、無機フッ素化合物をフッ素化剤として利用して合成される。図1にフッ素化合物の流れを示す。
<画像をクリックすると拡大します>
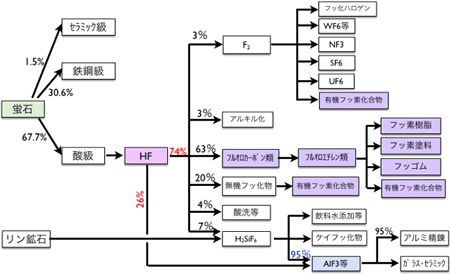
図1
●無機フッ化物->有機フッ化物->無機フッ化物の輪廻
図1に示すようにフッ素化学産業のキーマテリアルはフッ化水素(化学式:HF)で、これは螢石(CaF2)と硫酸との反応でつくられる。そのフッ化水素の大半は、塩素化合物などをフッ素色に染めるフルオロカーボン類(フロン類)の製造に使用される。次に多いのがアルミニウム精錬用のフッ化アルミニウムである。
不要になった有機フッ素化合物はそのままでは破棄できない。まずは、フッ素と炭素結合を切って無機化する必要がある。その代表的なものがフロンの破壊である。一般的には、高温での熱分解によりフロンをフッ化水素、炭酸ガス、塩化水素といった物質に無機化した後、主にフッ化カルシウムとして固定化する。
同様に、フッ素化合物の合成反応や半導体産業などで使用した使用済みの無機フッ素化合物は、大部分がフッ化カルシウムとして固定化される。この回収したフッ化カルシウムを再度フッ化水素製造用の原料に利用しようというのが現在行われているフッ素リサイクルの主流である。
フッ素、および、その化合物のフッ素濃度に関して、水道法の水道水質基準値、および、水として環境基準(健康項目)や地下水環境基準では0.8 mg/L以下であることが定められている。また、水質汚濁防止法(健康項目)の排水基準では海域以外で8 mg/L、海域で15 mg/L以下であることが定められ、さらに、土壌環境基準(溶出量基準)では0.8 mg/L、土壌汚染対策法の特定有害物質として土壌溶出量基準で0.8 mg/L以下、土壌含有基準で4.000 mg/kg以下と定められている。このため、フッ素含有排水を排出する企業などはこれらの基準値を守るためにフッ素の固定化処理が必要となり、通常カルシウム化合物を用いてフッ化カルシウムとして固定化している。

|


